
Soluções químicas é um tema essencial para a prova do Enem. Com foco na classificação e fórmulas, o artigo busca...

Soluções químicas é um tema essencial para a prova do Enem. Com foco na classificação e fórmulas, o artigo busca elucidar os principais conceitos envolvidos, como solubilidade, natureza das partículas dispersas, coeficiente de solubilidade, diluição e mistura de soluções, além dos cálculos envolvidos e dicas práticas para resolução de questões de prova.
O post explora em detalhes o conceito de soluções químicas, um assunto essencial para quem está se preparando para o Enem e outros vestibulares. É abordado como as soluções se formam, suas classificações quanto à solubilidade e natureza das partículas, além da importância do coeficiente de solubilidade. Exemplos práticos de diferentes estados físicos de soluções são apresentados, facilitando a compreensão teórica e contextualização no cotidiano. Também são explicadas as principais fórmulas de concentração de soluções e como aplicá-las em cálculos, além de dicas práticas para revisão desse conteúdo. O artigo destaca a relevância do tema nas provas, especialmente no Enem, onde são frequentes questões que envolvem o uso dessas fórmulas em situações do dia a dia.
O conceito de soluções químicas está presente no preparo de um suco a partir de um concentrado, no ato de adoçar o café da manhã, bem como no oxigênio presente na água para que os peixes possam respirar.
Para você que está se preparando para o Enem ou vestibulares, dominar este tópico é essencial, pois ele aparece tanto em questões teóricas quanto naquelas que exigem cálculos de concentração.
Neste artigo, portanto, vamos explorar de forma completa e encadeada o mundo das soluções.
Você entenderá o que são, como se classificam, qual a importância do coeficiente de solubilidade e, sobretudo, como calcular a concentração de sol soluções químicas usando as fórmulas que mais caem nas provas.
Abordaremos também a diluição e a mistura de soluções, com exemplos práticos. Prepare-se para transformar sua compreensão sobre o assunto e garantir pontos preciosos na sua prova!
Embarque conosco nessa jornada de conhecimento!
As soluções químicas são misturas homogêneas formadas por duas ou mais substâncias.
Isso significa que, a olho nu ou mesmo em um microscópio comum, não é possível distinguir os componentes individuais. Isso porque elas apresentam uma única fase (monofásicas).
Uma solução é composta por dois elementos fundamentais:
A formação de uma solução ocorre quando as partículas do soluto (íons ou moléculas) são separadas e envolvidas pelas partículas do solvente, num processo chamado de solvatação.
Se o solvente for água, chamamos especificamente de hidratação.
Abaixo uma ilustração de uma solução química formada a partir da dissolução de sal na água. O resultado é uma mistura homogênea.

As soluções químicas estão tão presentes em nossa rotina que muitas vezes nem nos damos conta.
Não raro, ao se falar em soluções químicas, as pessoas imediatamente imaginam um laboratório com ampolas e outros aparatos um tanto exóticos, mas geralmente a questão é bem mais simples.
Conhecer soluções químicas e exemplos práticos, portanto, ajuda a fixar a teoria e a entender a importância das soluções químicas em diversos contextos.
Aqui estão alguns exemplos divididos por estado físico:
| Estado Físico da Solução | Exemplo | Soluto | Solvente |
|---|---|---|---|
| Sólida | Ligas metálicas (ouro 18 quilates) | Prata/Cobre (sólido) | Ouro (sólido) |
| Sólida | Aço (liga de ferro e carbono) | Carbono (sólido) | Ferro (sólido) |
| Líquida | Água com açúcar / Café adoçado | Açúcar (sólido) | Água (líquido) |
| Líquida | Refrigerante | Gás CO₂ (gás) | Água (líquido) |
| Líquida | Vinagre | Ácido acético (líquido) | Água (líquido) |
| Líquida | Soro fisiológico | NaCl (sólido) | Água (líquido) |
| Gasosa | Ar atmosférico (seco e limpo) | Gases (O₂, Ar) | Gás Nitrogênio (N₂) |
As soluções podem ser classificadas de diferentes maneiras, seja pela quantidade de soluto, pelo estado físico ou pela natureza das partículas dispersas.
Assim, para uma melhor compreensão, vamos detalhar os tipos de soluções químicas mais importantes para sua prova.
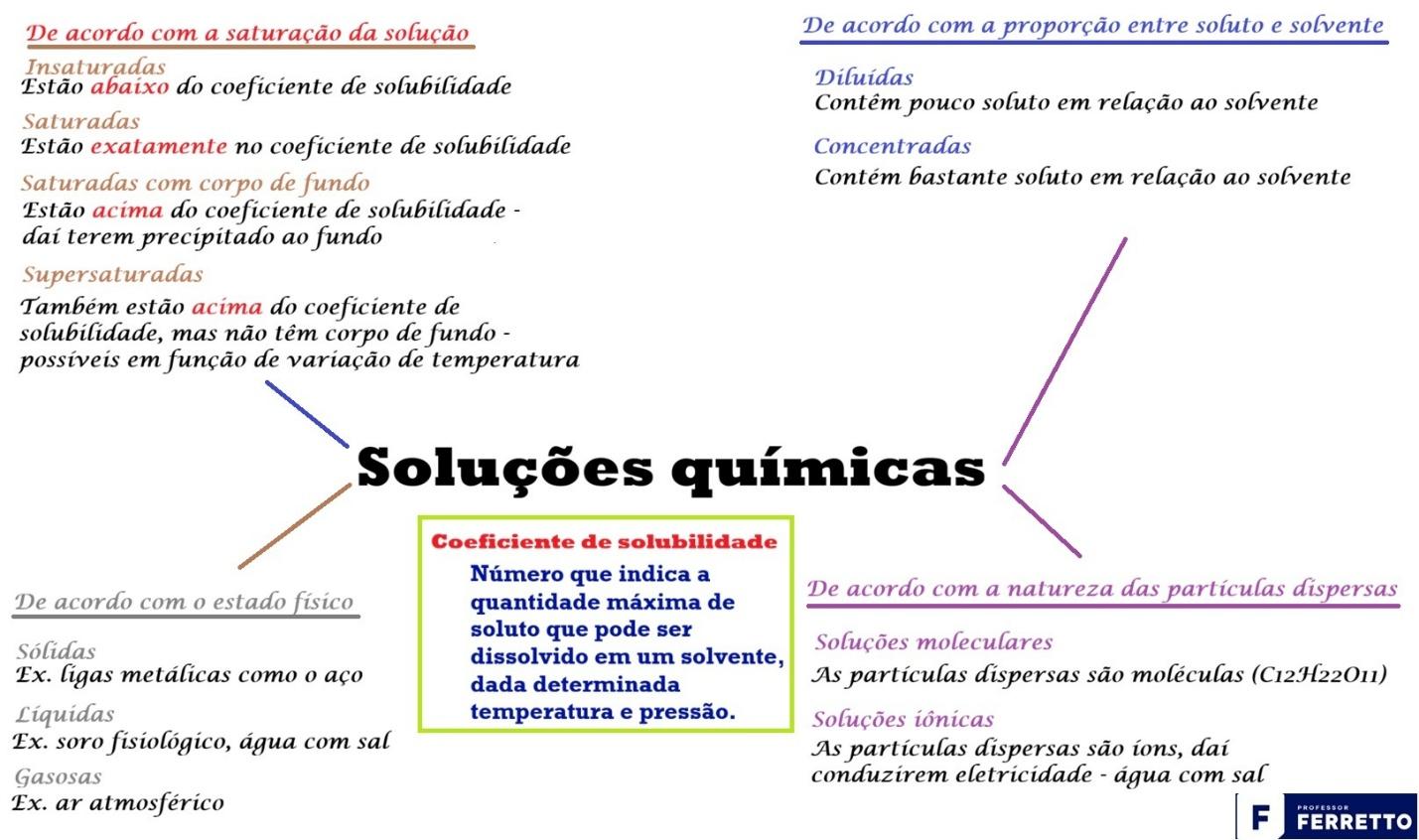
Esta é a classificação mais cobrada em vestibulares, pois está diretamente ligada ao conceito de coeficiente de solubilidade.
A imagem a seguir ilustra as soluções químicas quanto à quantidade de soluto, isto é, a solubilidade da solução. Pode-se notar que o solvente tem uma capacidade limite de dissolver o soluto.

Essa classificação é utilizada para se entender as propriedades das soluções em diferentes condições. Utilizada comumente em processos industriais e laboratoriais, visto a possibilidade ou não de conduzir corrente elétrica.
O coeficiente de solubilidade (Cs) é uma quantidade que define o “ponto de saturação”. Ele representa a capacidade máxima de um soluto se dissolver em uma determinada quantidade de solvente, em condições específicas de temperatura e pressão.
É fundamental, pois, entender que a solubilidade não é fixa; ela varia, principalmente, com a temperatura.
Exemplo clássico: o Cs do NaCl (sal de cozinha) é de aproximadamente 36 g de NaCl para cada 100 g de água a 20°C.
Isso significa que, nessa temperatura, 100 g de água dissolvem, no máximo, 36 g de sal. Se você colocar 40 g, 4 g formarão corpo de fundo.
Com base no coeficiente de solubilidade (Cs), reforçamos a classificação das soluções de forma mais técnica, conforme se pode ver abaixo:
Para facilitar e turbinar seus estudos, apresentamos abaixo um quadro resumo com as diferentes classificações das soluções químicas, conforme visto acima.
Chegamos a um dos pontos mais importantes e práticos: o cálculo da concentração de soluções químicas.
A concentração é a forma de medir a relação entre a quantidade de soluto e a quantidade de solvente (ou da solução).
Dominar as soluções químicas fórmulas é crucial para se sair bem no Enem ou no vestibular.
A tabela abaixo resume as principais fórmulas de concentração:
| Tipo de Concentração | Definição | Fórmula | Unidade (mais comum) |
|---|---|---|---|
| Concentração Comum (C) | Relação entre a massa do soluto (em g) e o volume da solução (em L). | g/L | |
| Molaridade ou Concentração em Quantidade de Matéria (M) | Relação entre o número de mols do soluto (n₁) e o volume da solução (em L). | ou | mol/L |
| Título em massa (τ) | Relação entre a massa do soluto (m₁) e a massa total da solução (m). É adimensional e geralmente expresso em porcentagem (τ × 100). | ou | (adimensional) |
| Título em volume | Relação entre o volume do soluto e o volume total da solução. Comum para líquidos e gases. | (adimensional) | |
| Partes por milhão (ppm) | Usada para soluções muito diluídas. Indica quantas partes de soluto existem em 1 milhão de partes da solução. | ppm |
Relação importante: A concentração comum (C) pode ser relacionada com o título (τ) e a densidade (d) da solução através da fórmula: C = 1000.d.τ (onde d está em g/ml).
As soluções químicas podem ser diluídas ou misturadas. A seguir vamos verificar o comportamento das soluções em ambas as situações.
Diluir uma solução significa adicionar mais solvente a ela.
E o que acontece então?
O volume da solução aumenta, mas a quantidade de soluto (massa ou número de mols) permanece a mesma. Por isso, a concentração diminui.
Fórmula fundamental da diluição:
Ci.Vi=Cf.Vf
Ou, para a molaridade:
Mi.Vi=Mf.Vf
Onde “i” é o valor inicial e “f” é o valor final.
Exemplo prático: Você tem 200 ml de uma solução de NaOH com concentração de 10 g/l. Se você adicionar água suficiente para completar 500 ml, qual a nova concentração?
Aplica-se a fórmula:
10 g/l x 0,2 l = Cf x 0,5 l → Cf = 4 g/l
Quando misturamos duas soluções do mesmo soluto, a quantidade total de soluto é a soma das quantidades das soluções iniciais, e o volume total é a soma dos volumes (se forem miscíveis e não houver contração volumétrica significativa).
Fórmula fundamental da mistura:
C1.V1+C2.V2=Cf.Vf
Ou, para molaridade:
M1.V1+M2.V2=Mf.Vf
Exemplo prático: Misturam-se 300 ml de uma solução de glicose de 15 g/l com 200 ml de outra solução de glicose de 20 g/l. Qual a concentração da solução final?
Aplica-se a fórmula:
(15 x 0,3) + (20 x 0,2) = Cf x 0,5 → 4,5 + 4 = Cf x 0,5 → Cf = 17 g/l
O Enem adora contextualizar a química. Com soluções, obviamente, não é diferente.
As questões geralmente envolvem a interpretação de situações cotidianas, rótulos de alimentos, medicamentos ou problemas ambientais, exigindo que o estudante aplique as fórmulas de concentração de soluções químicas.
Vamos resolver duas questões típicas:
Questão 1 (Concentração Comum – adaptada)
Um estudante preparou 500 ml de uma solução dissolvendo 20 g de NaCl em água. Qual a concentração comum, em g/l, dessa solução?
Resolução comentada:
Portanto, a concentração da solução é de 40 gramas de sal por litro de solução.
Questão 2 (Molaridade – Enem – adaptada)
Soro fisiológico contém 0,900 gramas de NaCℓ, massa molar = 58,5 g/mol, em 100 ml de solução aquosa. A concentração do soro fisiológico, expressa em mol/l, é igual a:
a) 0,009
b) 0,015
c) 0,100
d) 0,154
e) 0,900
Resolução comentada:
Aplicando na fórmula:
M=0,900 / (58,5 x 0,1) M=0,900 / 5,85 M=0,1538…≈0,154 mol/l
Resposta: A alternativa correta é a letra d) 0,154.
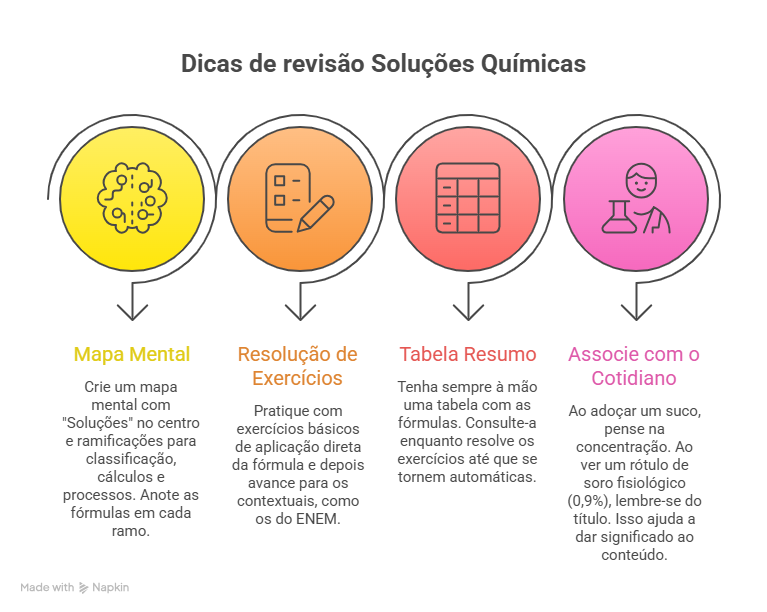
Para aprender de forma mais consistente sobre soluções químicas e dominar suas fórmulas, bem como dominar outros conceitos do campo da química, apresentamos abaixo um infográfico com algumas dicas e técnicas de estudo que podem ser muito úteis na sua preparação para o Enem ou vestibular.
O Curso Professor Ferretto se destaca por focar numa preparação completa, direta e alinhada com as exigências das principais provas, destacando-se como uma autoridade no segmento.
Sua metodologia, que combina teoria objetiva com resolução massiva de exercícios, é ideal para quem precisa entender conceitos como a soluções químicas e outros conceitos de química de forma definitiva e aplicada.
O curso oferece uma estrutura que guia o aluno desde os fundamentos até os tópicos mais complexos, garantindo que nenhum detalhe importante fique para trás.
Quer levar seu estudo de Química e outras matérias para um patamar mais elevado?
👉 Acesse agora o curso gratuito do Professor Ferretto e experimente uma metodologia que já ajudou milhares de estudantes a alcançarem sua aprovação.
👉 Para um mergulho profundo e preparação completa para o Enem, explore os planos do Enem Anatomy.
As soluções químicas são um pilar fundamental da química e um tópico bastante recorrente no Enem e vestibulares.
Compreender seus conceitos, desde a simples definição de soluto e solvente até os cálculos mais complexos de concentração, diluição e mistura, é essencial para o seu sucesso.
Vimos que a concentração de soluções químicas pode ser expressa de diversas formas, como concentração comum, molaridade e título, cada uma com sua aplicação específica.
Dominar essas soluções químicas e saber aplicar suas fórmulas em contextos práticos é a chave para resolver as questões com confiança.
Portanto, revise os conceitos, pratique bastante com os exercícios e utilize as dicas de revisão para consolidar seu aprendizado.
Com dedicação, você estará pronto para transformar esse conhecimento em pontos na sua prova.
Bons estudos!

