
O número atômico, representado por Z, é a quantidade de prótons no núcleo do átomo. O número atômico dá identidade...

O número atômico, representado por Z, é a quantidade de prótons no núcleo do átomo. O número atômico dá identidade aos elementos químicos, determina suas propriedades e comportamentos e os organiza na Tabela Periódica. Daí ser essencial para decifrar questões complexas do Enem e vestibulares. Além disso, o entendimento do número atômico possibilita conexões com aplicações tecnológicas modernas, sendo vital para a estruturação e o estudo da matéria.
O número atômico, representado por Z, é fundamental para a compreensão química, sendo a quantidade de prótons no núcleo do átomo. Compreender o número atômico vai além da simples memorização e é essencial para decifrar questões complexas do Enem e vestibulares. Esse número é central para identificar elementos, organizá-los na Tabela Periódica e determinar suas propriedades e comportamento. Dominar essa diferença é crucial para acertar questões no Enem, onde o número atômico aparece em raciocínios mais complexos, como identificação de elementos, análise de propriedades periódicas, distinção entre isótopos e íons, entre outros. Além disso, o entendimento do número atômico possibilita conexões com aplicações tecnológicas modernas, sendo vital para a estruturação e o estudo da matéria.
Para muitos estudantes, o número atômico parece ser apenas mais um dado para decorar da Tabela Periódica – aquele pequeno numeral acima do símbolo do elemento.
No entanto, compreender profundamente o que ele representa é a diferença entre memorizar conteúdos e realmente dominar a química para provas como o Enem e os vestibulares.
Este conceito é a pedra angular, pois conecta a estrutura do átomo, a organização dos elementos, sua reatividade e as aplicações tecnológicas que moldam o mundo moderno.
Por isso, neste artigo, vamos desvendar o número atômico além da teoria básica, mostrando como ele é a chave para resolver questões complexas, entender desde a composição de chips de silício até o funcionamento de baterias de íon-lítio, e, principalmente, garantir um alto desempenho nas suas provas.
Prepare-se para descobrir que esse “simples número” é, na verdade, a identidade fundamental de tudo o que é matéria. Vamos lá!
O número atômico, representado pela letra Z, nada mais é que a quantidade de prótons existentes no núcleo de um átomo.
Tome nota disso, pois, essa definição é central e imutável.
Cada elemento químico, portanto, possui um número atômico único, que funciona como o CPF do próprio elemento químico.
Não há, por conseguinte, nenhum exemplo de dois elementos químicos que tenham o mesmo número atômico.
Por exemplo, todo átomo que possui apenas 1 próton é sempre o hidrogênio. Todo átomo com 6 prótons é sempre carbono.
Basta, pois, acrescentar ou subtrair um único próton de um núcleo atômico que se terá outro elemento químico. De ser ver, portanto, que, alterado o número atômico, alterado o elemento químico.
A melhor maneira de se saber o número atômico de um elemento é consultando a Tabela Periódica.
Na Tabela Periódica, os elementos estão organizados em ordem crescente de número atômico, geralmente apresentado acima do símbolo do elemento.
Assim, descobrir o número atômico é simples, basta localizar o respectivo elemento químico na tabela e verificar seu respectivo número atômico.
Atenção para o detalhe curioso a seguir, do qual muitos estudantes sequer se dão conta!
Em um átomo neutro (sem carga elétrica líquida), o número de prótons (carga positiva) é igual ao número de elétrons (carga negativa).
Disso decorre que, em um átomo neutro, o número atômico também indica o número de elétrons.
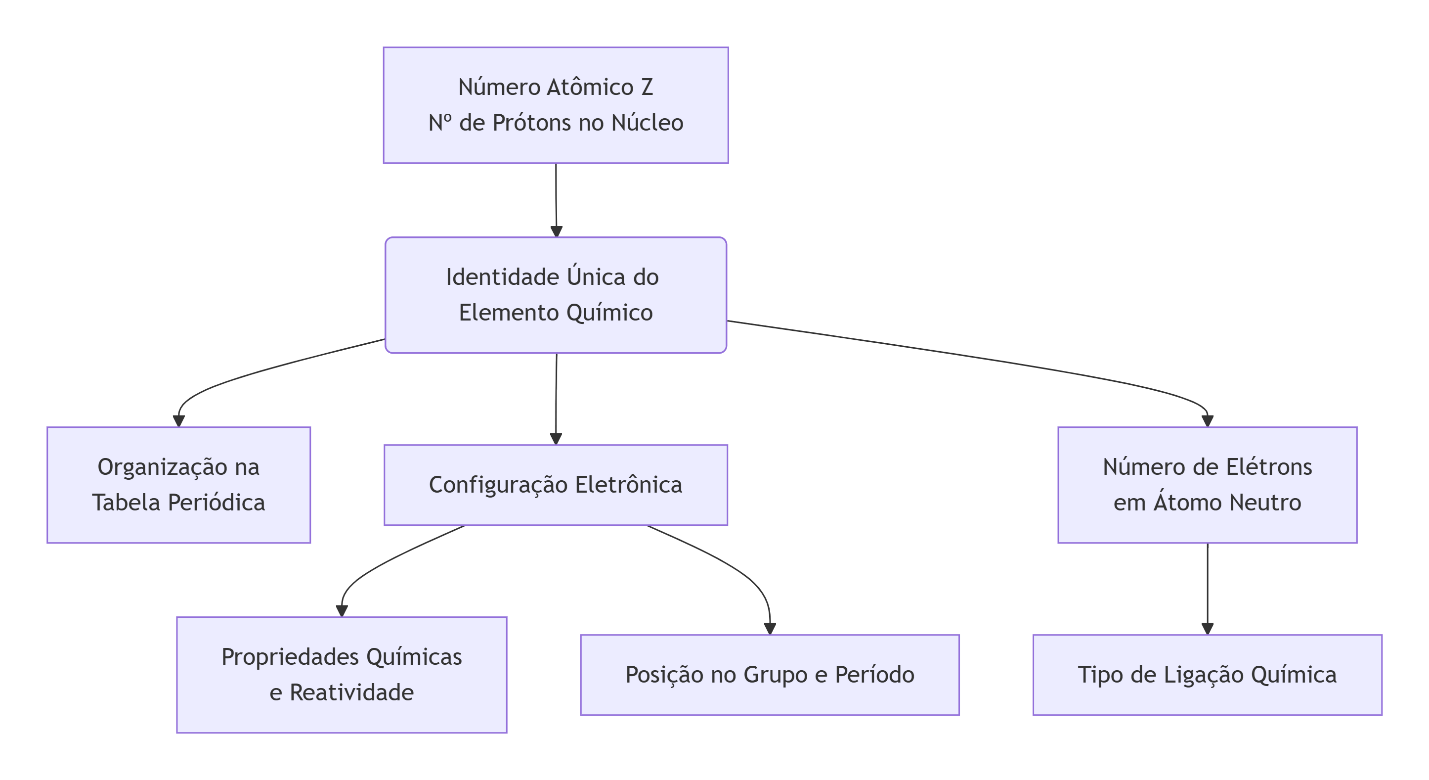
A função do número atômico, além de indicar o número de prótons no núcleo do elemento, conforme visto acima, também dá pistas de onde encontrar o elemento na Tabela Periódica, além de indicar propriedades desse elemento químico, como veremos a seguir.
Para facilitar a sua compreensão, apresentamos a seguir um diagrama conceitual sobre a importância do número atômico e características decorrentes.
Confundir número atômico (Z) com número de massa (A) ou massa atômica é um dos erros mais comuns. Dominar essa diferença é crucial para acertar questões.
Apresentamos a seguir uma tabela com elementos identificativos e diferenciadores entre número atômico e número de massa.
| Característica | Número Atômico (Z) | Número de Massa (A) |
|---|---|---|
| O que representa? | Número de prótons no núcleo. | Soma de prótons e nêutrons no núcleo (A = Z + n). |
| É único para o elemento? | SIM. Define o elemento. | NÃO. Pode variar entre isótopos do mesmo elemento. |
| Onde encontrar? | Na Tabela Periódica, acima do símbolo. | Geralmente não está na tabela. A tabela mostra a massa atômica, que é a média ponderada dos isótopos. |
| Pode mudar sem alterar o elemento? | NÃO. Se mudar, o elemento se transforma. | SIM. A variação no número de nêutrons cria isótopos. |
| Exemplo no Carbono | Z = 6 (sempre 6 prótons). | Pode ser A=12 (Carbono-12, com 6 nêutrons) ou A=14 (Carbono-14, com 8 nêutrons). |
Resumindo:
O número atômico responde “quem” é o átomo.
Já o número de massa dá uma ideia de “quanto pesa” aquele núcleo específico.
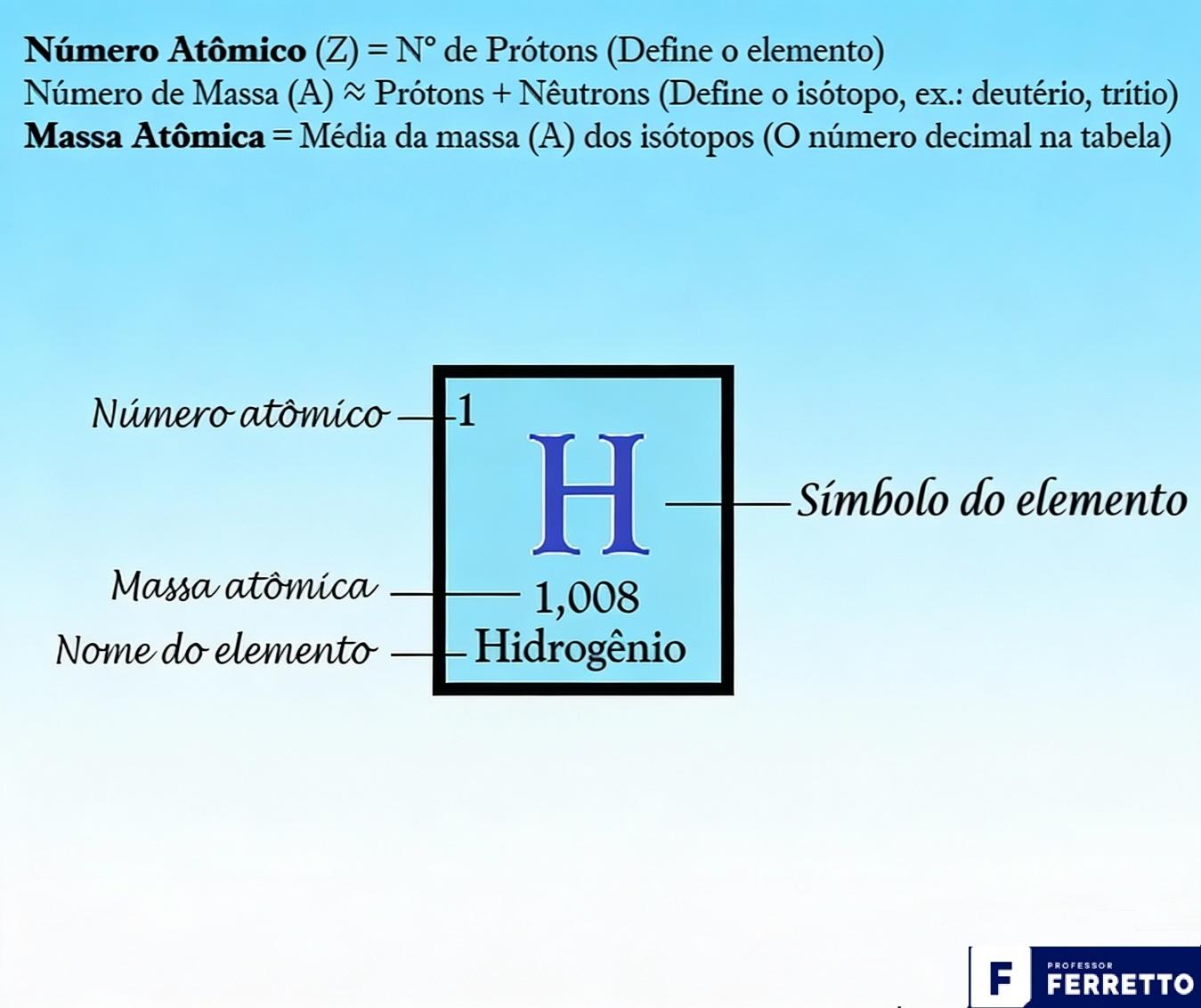
A imagem abaixo ilustra como um elemento químico (no caso o hidrogênio) é apresentado na Tabela Periódica com alguns de seus elementos identificadores.
A Tabela Periódica moderna é um mapa organizado pelo número atômico.
Ele aumenta sequencialmente da esquerda para a direita e de cima para baixo.
Mas a magia vai além da simples numeração, como se pode ver a seguir.
O lítio (Z=3) está no 2º período e tem 2 camadas; o sódio (Z=11) está no 3º período e tem 3 camadas.
Isso ocorre porque eles possuem o mesmo número de elétrons na camada de valência (a mais externa), uma consequência direta da sequência do número atômico e do preenchimento eletrônico.
Todos os metais alcalinos (Grupo 1), por exemplo, têm 1 elétron na camada de valência, o que os torna extremamente reativos.
Dessa forma, ao consultar a posição de um elemento na tabela, você está, na verdade, lendo informações preciosas sobre sua estrutura atômica, derivadas diretamente do seu número atômico.
Se o número atômico (Z) nos dá o número de prótons e, num átomo neutro, o número de elétrons (conforme visto acima), a pergunta lógica a se fazer é: como esses elétrons se distribuem ao redor do núcleo?
A resposta está na distribuição eletrônica por níveis de energia, também conhecida como configuração eletrônica.
O número atômico é, pois, a entrada para esse processo.
A título de exemplo, tome-se um átomo de sódio (Na), com Z=11, sabemos, por consequência, que ele tem 11 elétrons em seu estado fundamental.
Seguindo as regras de preenchimento (diagrama de Linus Pauling, ordem energética 1s² 2s² 2p⁶ 3s¹…), distribuímos esses 11 elétrons, chegando à configuração:
1s² 2s² 2p⁶ 3s¹.
Essa configuração final nos revela características específicas do elemento químico, no caso o sódio (Na). Vê-se, pois, que:
Pode-se ver, portanto, que o número atômico é o ponto de partida que, através da distribuição eletrônica, nos leva diretamente a posição na tabela e as propriedades do elemento.
Note, pois, que é uma cadeia lógica poderosa: Z → número de elétrons → distribuição eletrônica → camada de valência → posição na tabela → propriedades químicas.
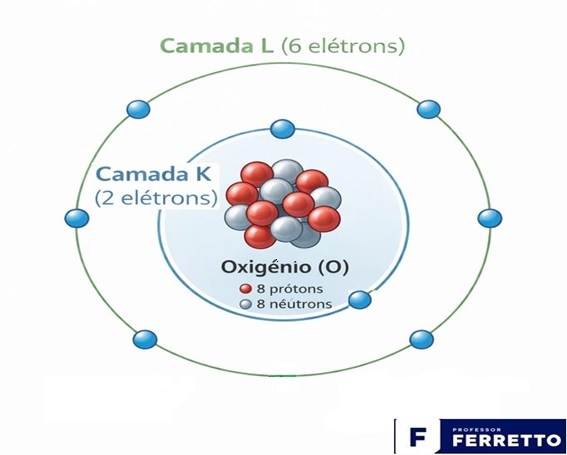
Abaixo é apresentado uma ilustração do átomo de oxigênio que possui duas camadas de energia em torno de seu núcleo pelas quais seus respectivos elétrons estão distribuídos.
A reatividade química de um elemento — sua tendência de ganhar, perder ou compartilhar elétrons — é diretamente governada pela configuração da sua camada de valência, que, como vimos, é determinada pelo número atômico.
Abaixo são apresentadas algumas características da configuração de eletrônica (elétrons na camada de valência) que são comuns para determinados grupos de elementos químicos.
A partir das informações apresentadas acima, não fica difícil de entender que não é por acidente que sódio (Z=11) reage violentamente com água e cloro (Z=17), um gás amarelo-esverdeado tóxico.
Suas “personalidades” químicas foram moldadas desde o momento em que seus números atômicos foram definidos.
Aqui reside outra distinção crucial entre átomos que é fundamental compreender para se sair bem nas provas.
Conclusão chave: processos químicos comuns (ligações iônicas, covalentes) envolvem apenas os elétrons. O número atômico (núcleo) permanece intacto. Para alterar o número atômico, são necessárias reações nucleares (fusão, fissão, decaimento radioativo), que transformam um elemento em outro.
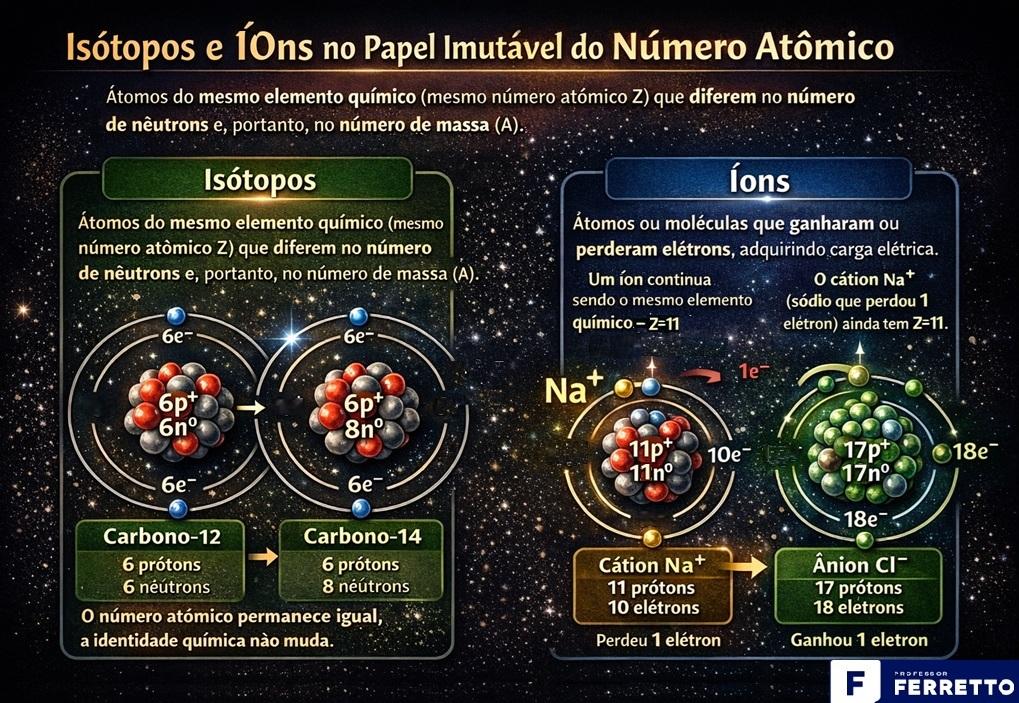
Abaixo, para melhor compreensão, ilustração que diferencia isótopos (um mesmo elemento químico com diferente número de nêutrons) de íons, que podem ser positivos (cátion – perde um elétron) ou negativos (ânion – ganha um elétron).
Para ir além dos estudos e conectar o conceito ao mundo real, apresentamos, no infográfico abaixo, algumas aplicações tecnológicas oriundas do entendimento do número atômico e consequentes características de diferentes elementos químicos.
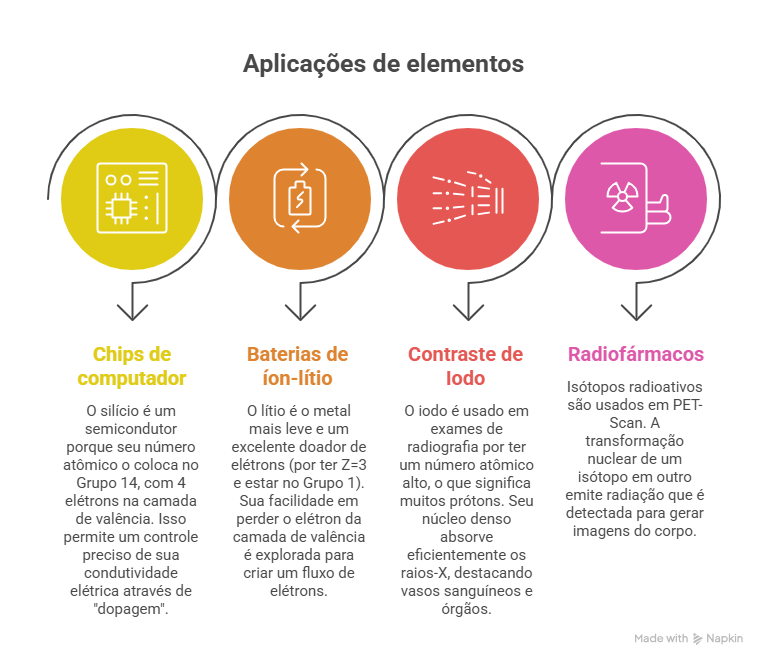
O número atômico raramente é cobrado de forma isolada. Ele aparece como base para raciocínios mais complexos.
Veja os principais temas:
Treine a aplicação direta dos conceitos. Tente resolver em menos de 10 segundos cada.
1. (ENEM/Adaptada) Um átomo do elemento X possui 26 prótons, 26 elétrons e 30 nêutrons. Qual seu número atômico (Z) e número de massa (A)?
Raciocínio Rápido: Z = número de prótons = 26. A = prótons + nêutrons = 26 + 30 = 56.
Gabarito: Z=26, A=56.
2. (Modelo ENEM) Os elementos Lítio (Li, Z=3), Sódio (Na, Z=11) e Potássio (K, Z=19) apresentam propriedades químicas semelhantes. Essa semelhança é justificada por:
a) Possuírem o mesmo número de camadas eletrônicas.
b) Apresentarem a mesma eletronegatividade.
c) Terem o mesmo número de elétrons na camada de valência.
d) Possuírem massas atômicas muito próximas.
Raciocínio Rápido: Eles pertencem ao mesmo grupo (1) da tabela periódica. A semelhança nas propriedades dentro de um grupo se deve à mesma configuração na camada de valência.
Gabarito: c.
3. (UNESP/2024 – Adaptada) O radionuclídeo Flúor-18 (¹⁸F) é usado em PET-Scan. Ao emitir uma partícula, transforma-se no isótopo Oxigênio-18 (¹⁸O). Os números atômicos do Flúor e do Oxigênio são, respectivamente, 9 e 8. Essa transformação envolve mudança no:
a) Número de elétrons apenas.
b) Número de nêutrons apenas.
c) Número atômico.
d) Número de massa.
Raciocínio Rápido: Se o produto é Oxigênio (Z=8) e o original era Flúor (Z=9), houve mudança no número atômico (nº de prótons). É uma reação nuclear.
Gabarito: c.
Porque ele determina a configuração eletrônica, especialmente o número de elétrons na camada de valência. É a busca por uma configuração estável (geralmente 8 elétrons na última camada, regra do octeto) que “motiva” os átomos a reagirem, perdendo, ganhando ou compartilhando elétrons.
Em um exercício, as informações geralmente são dadas de forma direta (“o elemento X possui Z=11”) ou indireta, fornecendo o número de prótons, ou ainda o número de massa e de nêutrons (Z = A – n). No cotidiano, a tabela periódica é a ferramenta fundamental.
Nunca. O número atômico é sempre um número inteiro, pois representa a contagem discreta de prótons. O valor fracionário que aparece na Tabela Periódica é a massa atômica (média ponderada das massas dos isótopos naturais).
Sim. A formação de íons envolve apenas a perda ou ganho de elétrons. O núcleo, onde estão os prótons que definem o número atômico, permanece inalterado.
O Curso Professor Ferretto se destaca por focar numa preparação completa, direta e alinhada com as exigências das principais provas, destacando-se como uma autoridade no segmento.
Sua metodologia, que combina teoria objetiva com resolução massiva de exercícios, é ideal para quem precisa entender conceitos como a número atômico e outros conceitos de química de forma definitiva e aplicada.
O curso oferece uma estrutura que guia o aluno desde os fundamentos até os tópicos mais complexos, garantindo que nenhum detalhe importante fique para trás.
Quer levar seu estudo de Química e outras matérias para um nível mais elevado?
👉 Acesse agora o curso gratuito do Professor Ferretto e experimente uma metodologia que já ajudou milhares de estudantes a alcançarem sua aprovação.
👉 Para um mergulho profundo e preparação completa para o Enem, explore os planos do Enem Anatomy.
Como vimos, o número atômico é a propriedade fundamental que define a identidade de um elemento químico.
Sua imutabilidade, visto que alterá-lo significa criar um novo elemento, o torna a pedra angular da Química.
Assim, além de ser a chave para a organização dos elementos na Tabela Periódica em ordem crescente, o número atômico é o ponto de partida para a compreensão das propriedades químicas e da reatividade, explicando padrões e comportamentos.
Portanto, dominar o conceito de número atômico é compreender a base que conecta a estrutura atômica ao comportamento macroscópico da matéria, sendo indispensável para o estudo científico e suas inúmeras aplicações tecnológicas.
Tenha, pois, em mente para o Enem e vestibulares que, a partir da identificação do número atômico, uma série de propriedades e comportamentos se tornam previsíveis.
